 |
  Introduction Introduction
L'idée que l'on se fait d'un objet est souvent liée à l'aspect extérieur de celui-ci.
Parfois un simple examen à l'oeil nu suffit pour savoir si un matériau a des propriétés
métalliques ou isolantes, s'il est oxydé, ou mieux dans quelle gamme d'ondes se trouve sa
fréquence plasma. Mais dans la majorité des cas, cette image que l'on perçoit et qui n'est
autre que la surface de l'échantillon est imprécise. Comment, en effet, rendre compte des
phénomènes de contaminations, d'adsorption moléculaire, de traitements plasmas, ou
encore de dépôts de couches minces ?
Pour étudier les surfaces à l'échelle macroscopique, il nous faut donc un outil qui nous permette de suivre ces évolutions et nous laisse la possibilité de modifier ces surfaces pour les améliorer. Il existe plusieurs techniques de caractérisation qui seules ou couplées entre-elles permettent d'étudier les propriétés physico-chimiques des surfaces. Dans ce numéro spécial, notre attention se focalise sur l'XPS, technique particulièrement adaptée à la caractérisation de la chimie des surfaces.  L'historique L'historique
Si les principes de base de cette technique étaient connus depuis le début des années
1900 (rayons X et photoémission), ce n'est qu'en 1950 que les premiers travaux du
professeur Kai Siegbahn de l'université d'Uppsala (Suède) ont permis de donner naissance
à l'XPS. Il faudra attendre les années 70 pour que soient mis sur le marché des spectromêtres
performants permettant à l'XPS de s'imposer comme une des techniques de
référence pour l'étude des surfaces.
 Le principe Le principe
L'interaction de photons X avec la matière rend instables les atomes qui la composent.
Cet apport d'énergie, pour peu qu'il soit suffisant, permet aux électrons qui gravitent
autour du noyau de rompre l'attraction qui les maintient sur leurs orbitales. Ils quittent
alors l'atome avec une énergie cinétique. Propulsés dans la matière, ils parcourent une
distance qui est fonction de cette énergie et du matériau dans lequel ils évoluent. Si leur
énergie est suffisante, les électrons atteignent la surface, sont extraits du matériau et
passent dans le vide.
Le bilan énergétique est: El est l'énergie de liaison de l'électron avec le noyau Ec est l'énergie cinétique dans le vide de l'électron éjecté W est l'énergie nécessaire à l'électron pour franchir la frontière matériau/vide (travail de sortie) h est la constante de Planck ν est la fréquence de l'onde. Ces grandeurs sont reportées sur le schéma de principe n°1. 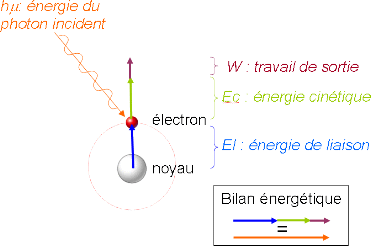 Les électrons émis, sous l'effet des photons, sont collectés et comptés en fonction de leurs énergies cinétiques. W et hν étant préalablement déterminés, la relation 1 permet de calculer les énergies de liaisons. La figure 1 présente le spectre ainsi obtenu dans le cas d'un matériau de carbone oxydé. 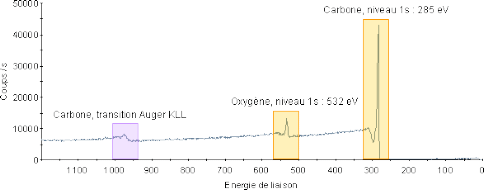 Ce spectre général présente trois pics de nature différente : pics de coeur (orbitales proches des différents noyaux) et pics Augers (transitions Auger).L'énergie de ces pics permet, à partir de tables, d'identifier la nature des atomes d'où proviennent ces électrons. On distingue deux pics de coeur Carbone 1s et Oxygène 1s et une transition Auger KLL du carbone. La détermination des éléments chimiques présents dans cet échantillon étant réalisée, il devient possible de quantifier la part de chacun d'eux et d'établir leur répartition dans le matériau. Une exploitation de ces résultats ne peut se faire qu'avec une connaissance précise des caractéristiques techniques de l'appareillage. Ces dernières sont présentées de manière synthétique dans le paragraphe suivant. L'irradiation de la matière par des rayons X entraîne l'éjection d'électrons. L'énergie de ces électrons permet d'identifier les éléments présents à la surface d'un matériau. |